生物制品行业请谨慎使用铸造材质

无菌药品是指法定药品标准中列有无菌检查项目的制剂和原料药,包括注射剂、眼用制剂、无菌软膏剂、无菌混悬剂等。生物制品是应用普通的或以基因工程、细胞工程、蛋白质工程、发酵工程等生物技术获得的微生物、细胞及各种动物和人源的组织或液体等生物材料制备的,用于人类预防、治疗和诊断的药品。
无菌药品与生物制品的生产须满足其质量和预定用途的要求,应最大限度降低微生物、各种微粒和热原的污染。目前,随着我国制药行业的快速发展,无菌药品与生物制品在微生物控制方面的风险管控能力已经取得了很大的进展;而在内源性颗粒物污染的风险管控方面,我国制药行业还认识不足,需全行业同仁共同关注与警惕。
316L材质组成的注射用水系统、不锈钢无菌与生物工艺系统中,焊接质量与钝化质量是最为关键的两个环节。在欧、美等发达国家的制药工业领域,316L材质(无论1.4435还是1.4404)均是使用锻造加工成型工艺,不存在铸造加工成型工艺的滥用。
(1)焊接环节 必须采用至少99.99%的充氩保护,才能得到光亮有效的焊缝颜色,根据图1的颜色对比表,要求至少为3级以上(含3级)的回火色才符合使用的要求,否则内窥镜检查将判定该焊口为不合格焊口并需要做重新焊接处理。

图1 内窥镜氧化辨别图
(2)钝化环节 就提高标准等级不锈钢的抗腐蚀性而言,钝化处理是最佳选择,也是必要程序。《ASME BPE 2014》关于洁净不锈钢管道系统钝化章节对钝化工艺的设计、执行规范及验收方法都给出了明确的阐述。内容涵盖特种设备及BPE级设备在安装、定位或改造之后所进行的初始水冲洗、化学清洗、脱脂、钝化及最终冲洗等程序的准备和执行,它还规定了针对与生物、制药工程及个人护理用品业产品直接接触的生产系统及部件的钝化工艺的审查办法,同时提供了若干钝化程序的信息及对各种钝化工艺完成后的表面钝化效果的确认方法。其特别指明所涵盖的内容适用于316L不锈钢及更高等规格合金材料。锻造加工成型工艺组成的不锈钢系统,钝化技术方案应确保钝化过程中各参数的合理性以实现对待处理系统中游离铁的有效去除并能够使钝化效果验收试件满足表2中的各项要求。
| 试件材质 | 测试方法 | 烙铁比 | 纯化莫层深 |
| 316L不锈钢 | 俄歇电子能谱分析 | 1.0及以上 | ≥15埃米 |
| 316L不锈钢 | 辉光光谱分析 | 1.0及以上 | ≥15埃米 |
| 316L不锈钢 | 光电子能谱分析 | 1.3及以上 | ≥15埃米 |
表2 钝化效果检测标准
目前,在我国原材料市场上,按加工工艺的不同,隔膜阀、离心泵叶轮等关键部件分为锻造件和铸造件,虽然外观上没有太大区别,但在扫描电镜下的影像图下(图3)却有非常大的区别。需要注意的是,任何与酸洗钝化工艺和钝化膜等参数相关的判定标准与法规指南均是基于锻造件的研究结果。例如,《药品生产验证指南》、《SJ 20893-2003不锈钢酸洗和钝化规范》、《ASTM A967》与《ASME BPE》等。

图3 铸造与锻造
铸造是指将金属熔炼成符合一定要求的液体并浇灌进铸件模型,经冷却凝固、清整处理后得到有预定形状、尺寸和性能的铸件的工艺过程,铸造属于现代机械制造工业的基础工艺,铸造生产得到的毛坯成本相对低廉,对于形状复杂、特别是具有复杂内腔的零件,更能显示出它的经济性;同时它的适应性较广,并具有较好的综合机械性能。
锻造是指利用锻压机械对金属坯料施加压力,使其产生塑性变形以获得具有一定机械性能、一定形状和尺寸锻件的加工方法,通过锻造能消除金属的铸态疏松与焊合孔洞等缺陷,优化微观组织结构;同时,由于保存了完整的金属流线,316L材料锻件的机械性能与抗腐蚀性能(红锈)远优于316L材料的铸件
红锈是制药用水系统中不锈钢材质一种常见的工程现象,任何高温或常温运行的不锈钢材质建造的制药用水系统,在运行一段时间后都会有红锈现象出现。红锈属于颗粒物污染,会影响制药用水质量与药品澄清度;增加过滤器的有效工作负荷;影响不锈钢系统耐压能力和耐腐蚀能力;与最终产品可能发生理化反应。引起红锈产生的因素较多,例如:高温或者高压环境中;氯化物等高腐蚀性环境;非不锈钢成分;以及不恰当的表面制备(如焊接质量问题、材料表面缺陷、不恰当的清洗或钝化等)均会诱发红锈的产生。
图4是80℃注射用水储存与分配系统的设备运行时间与不锈钢表面状态的模拟关系图(备注:来自HENKEL公司的文献WFI Systems with Supplemental Monitoring Syatem for Quatily Control in Connection with Rouging),从模型分析图可以看出,由电解抛光的锻造材质组成的不锈钢高温注射用水系统,初次钝化的钝化膜Cr/Fe>1.0,钝化层>1.5nm;出现一类红锈的时间大概是6个月之后,出现二类红锈的时间大概是8个月之后,稳定形成二类红锈至少需要一年的时间。
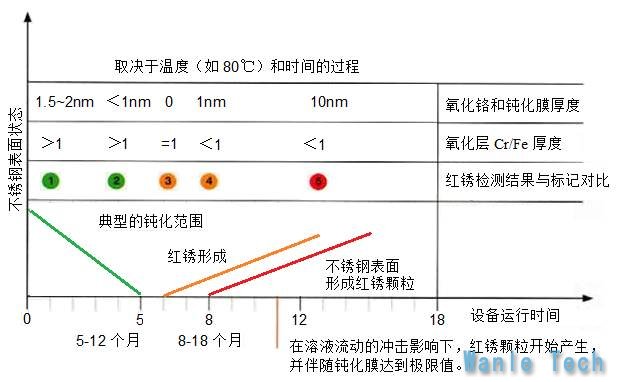
图4 红锈滋生的模拟分析图
虽然铸造元器件的发明由来已久,它并不是建立在制药级无菌与生物工艺系统基础上的。例如,铸造隔膜阀广泛应用在污水处理、化工防腐、饮用水输送等领域。使用铸件材料(隔膜阀、离心泵叶轮等)加工而成的无菌级生物工艺系统,因其无法形成致密的钝化膜保护层,不锈钢表面极易腐蚀,典型风险是快速滋生不正常的“红锈”、产品生产环节中存在较为严重的颗粒物污染质量风险,继而引发无法控制查明原因的微生物污染风险。图5是我国部分企业高温循环注射用水在使用不到2个月后开始出现的严重“红锈”现象,该红锈颗粒类似面粉一样,很容易搽拭掉,其主要原因就是系统选择的不锈钢材质存在大量铸造元器件,虽然企业采用了专业的除锈与再钝化措施,但该“红锈”现象还是反复频繁发生。

图5 铸造原材料引起的严重“红锈”
随着2010版中国GMP的深入实施,我国制药工程领域取得了前所未有的进步。一套不锈钢流体工艺系统的使用周期至少是十年以上,铸件原材料在注射用水、无菌与生物工艺系统中的普遍应用,衍生出的一系列颗粒物及微生物污染风险,将极可能变成我国无菌制药与生物制品企业的主要质量隐患之一,期待我国制药行业引起关注与重视。
参考文献
1. 国家药品食品监督管理局,药品生产质量管理规范(2010年修订),2010
2. 国家药典委员会,中华人民共和国药典2015年版,中国医药科技出版社,2015
3. European Pharmacopoeia 9th,2016
4. U.S. Pharmacopeia National Formulary 41,2017
5. The American Society of Mechanical Engineers,ASME BPE 2014,2014
6. ISPE,Volume 4:Water and Steam Systems (Second Edition),2011
7. WHO Expert Committee on Specifications for Pharmaceutical Preparations fourty-sixth Report,Annex 2:WHO Good Manufacturing Practices:Water for Pharmaceutical Use,2012
8. FDA,Guide to Inspections of High Purity Water Systems,1993
9. 国家食品药品监督管理局药品认证管理中心,中国医药科技出版社,GMP实施指南,2010
10. 化学工业出版社,制药用水系统,2016



