抗癌药力争零税率!这5款重磅进口新药强势冲击
3月20日上午,十三届全国人大一次会议闭幕后,国务院总理在回答中外记者提问时表示,愿意以更开放的姿态,进一步降低进口商品税率总水平。“一些市场热销的消费品包括药品,特别是群众、患者急需的抗癌药品,我们要较大幅度降低,降到零税率。”总理简简单单一句话,蕴含着巨大的信息量,给国内众多癌症患者带来了新的曙光。
长期以来,国内部分癌症患者必须依靠进口靶向药以及某些创新药延续生命。然而,这些药品由于专利限制,往往价格极高,单支抗癌药价格动辄上万元,且不能通过医保报销。面对“用钱买命”的负担,不少人选择放弃,有的人则被迫加入“购药大军”,到印度等周边国家采购低价“仿制药”。“海淘”药物现象的增多,尽管可以暂时缓解病痛、稳定病情,但因为没有了医生指导,药物的不良反应无人监测,安全性也得不到保证。2014年的闹得沸沸扬扬的“陆勇”案,也体现出国内部分癌症患者对高价进口药的无力承受。抗癌药品力争降到零关税,将立竿见影的降低药价,减轻患者及其家庭的经济负担,同时外资药企有更充分的价格空间去竞争中国抗癌市场。
根据CFDA进口药品数据库数据显示,目前国内进口抗肿瘤药为68款,其中31款为独家品种,仅有4款为生物制剂(均为单抗)。其中替尼类药物品种数最多,共计16款。据米内网MED中国药品审评数据库2.0数据显示,目前共有超过20家国内企业布局了替尼类药物,替尼类药物将在未来几年迎来井喷,竞争越发激烈。抗代谢药、激素类、烷化剂等传统化疗药品依旧占据较大比重,相对高端的生物靶向制剂仅4款,与发达国家之间的抗癌药物各类别比重有较大差别。不过随着国内越来越重视药物研发,各项激励政策的不断落地实施,相信在不久的将来会有更多更好的药物不断上市。
68款进口抗癌药物各类别数量统计(按产品名称统计)
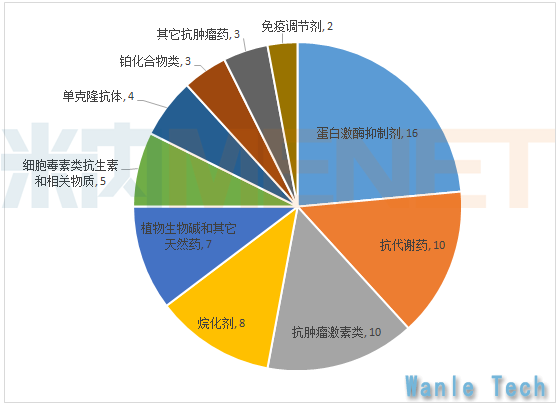
来源:米内网综合整理
2013-2016年公立医疗机构市场进口抗肿瘤药品牌TOP10
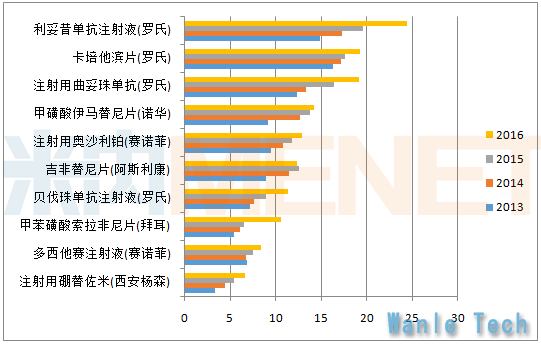
来源:米内网中国公立医疗机构终端竞争格局
罗氏连续多年位居抗癌药物企业市场份额占比榜首,也是唯一份额超过10%的企业,旗下拥有利妥昔单抗注射液、卡培他滨片、曲妥珠单抗注射液、贝伐珠单抗注射液这四个重点抗癌产品,呈现一家独大的局面。但随着时间的不断推移,预计未来三年将会有不少重磅进口新药以及国产抗癌药物陆续上市,生物制剂的比重将会不断加大,罗氏一家独大的局面极有可能一去不复返。
1.两大PD-1单抗即将登陆中国:Nivolumab And Pembrolizumab
纳武单抗(Nivolumab)是全球首个上市的PD-1单抗,最早在日本批准。自从2014年12月22日首次在美国获批用于黑色素瘤适应症以来,已经陆续被FDA批准了9大适应症。纳武单抗在中国二线治疗NSCLC的上市申请于2017年11月2日获得CDE承办受理,在2017年12月18日被CDE以"与现有治疗手段相比具有明显治疗优势"的理由纳入优先审评,目前该药已进入审评排队序列,预计2018年Q2能获批上市,极有可能成为第一款在国内获批的PD-1/PD-L1单抗。纳武单抗2015年全球销售额为9.82亿美元,2017年销售额为49.48美元,预计未来五年内销售峰值能达到95.9亿美元,在国内庞大的抗癌市场中也肯定能占得一席之地。
Nivolumab最新审评状态
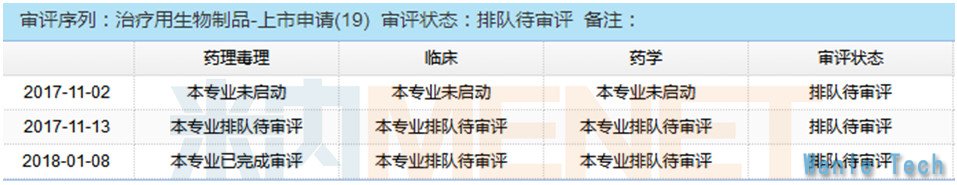
数据来源:米内网MED中国药品审评数据库2.0
派姆单抗(Pembrolizumab)是由默沙东公司开发,2014年10月28日在FDA批准上市,是第一只在美国上市的PD-1抑制剂。与Nivolumab相比,派姆单抗更领跑于PD-1在NSCLC的一线治疗。派姆单抗2015年全球销售额为5.66亿美元,2017年销售额为38.09亿美元,预计未来五年销售峰值能达到98.8亿美元。派姆单抗于2018年2月11月提交了中国上市申请,预计在2018Q3获批上市,极有可能成为第二款在国内上市的PD-1/PD-L1单抗。派姆单抗的强势一方面是因为在肺癌领域建立了较大领先优势,另一方面则是因为Keytruda在2017年5月被FDA批准用于治疗携带高度微卫星不稳定性(MSI-H)或者错配修复缺陷(dMMR)的实体瘤患者,是美国FDA批准的首款不依照肿瘤来源,而是依照生物标志物进行区分的抗肿瘤疗法,具有里程碑式的意义。不过默沙东在专利官司中输给了BMS,虽然Keytruda增长强劲,却不得不向BMS分成,两个超级重磅炸弹药物的厮杀将持续进行。
2.三大进口靶向药:更新换代、造福中国百姓
奥拉帕利(Lynparza)由阿斯利康开发,是全球首个上市的PARP抑制剂,最早在2014年12月被FDA加速批准,用于四线治疗晚期BRCA+卵巢癌,到目前已经批准了多个癌症适应症。迄今为止,Lynparza已经治疗了超过30000例晚期癌症患者,疗效得到充分的肯定。2017年该药全球销售额2.97亿美元,预计未来五年销售额峰值能达到13亿美元。奥拉帕利二线治疗卵巢癌的中国上市申请于2017年12月1日获得CDE承办受理,且被纳入优先审评,预计能在2018Q3获批,值得期待。
奥拉帕利在MED中国药品审评数据库2.0搜索结果

仑伐替尼由卫材开发,是一种口服多靶点激酶抑制剂,可抑制VEGFR-1,2,3、FGFR-1,2,3,4、PDGFR、RET和KIT。仑伐替尼2015年2月13日在美国获批上市,已批准用于治疗晚期甲状腺癌和肾癌,且还有肝细胞癌、脑胶质瘤和非小细胞肺癌等适应症的临床试验正在进行中。仑伐替尼2017年11月3日向CFDA提交上市申请,且获得优先审评,预计2018Q4能在中国获批上市。中国是肝癌患者大国,每年有大约39.5万例新确诊肝癌患者和38万例肝癌死亡患者,而目前索拉非尼是首个有明确证据显示能够改善晚期肝癌患者生存期的系统治疗药物,也是国内肝细胞癌患者的临床一线标准用药。仑伐替尼在与索拉非尼一项头对头对照实验中,以微弱优势取胜,良好的疗效势必会让其取得较好的销售成绩。
仑伐替尼在MED中国药品审评数据库2.0搜索结果

塞瑞替尼由诺华开发,2014年4月29日被FDA批准用于克唑替尼治疗不耐受或疾病进展的ALK+非小细胞肺癌,属于第二代间变性淋巴瘤激酶(ALK)抑制剂。诺华提交的塞瑞替尼胶囊上市申请在2017年12月11日正式获得CDE承办受理,且已纳入优先审评,预计可在2018Q4获得CFDA批准。在ASCEND-4研究结果显示,塞瑞替尼与标准一线化学疗法(培美曲塞、铂类)相比有着明显优势,相信能在中国抗癌市场取得不错成绩。
塞瑞替尼在MED中国药品审评数据库2.0搜索结果

结语
随着2015年药审制度大刀阔斧的改革之后,多项政策陆续出台实施,我国创新药、临床急需药的上市时间,已从改革前的平均7~8年,缩短到2~3年。在一系列的组合拳之后,可以明显预见未来几年将迎来重磅新药、仿制药的“井喷”期。国产队伍的实力不断壮大、优质进口新药的充分引入以及医保制度的改革,抗癌药物之间的竞争会变得越发激烈,进口抗癌药物的价格也会在竞争压力的增大和追求更大销量的双重原因下逐渐降低。价廉质优,将不再只存在于癌症患者心底的梦。



